Химики РУДН показали, как новое противоопухолевое лекарство взаимодействует с белками крови
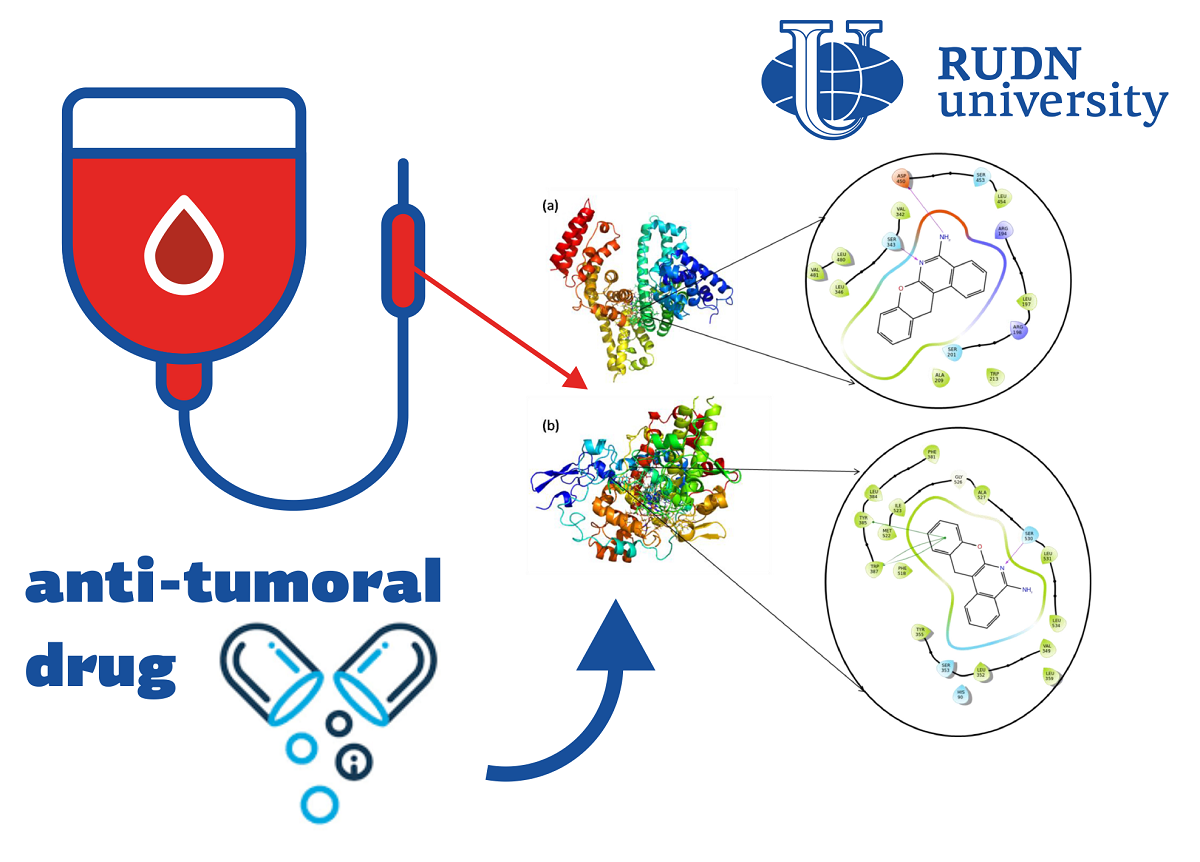
Гетероциклические соединения, в которых есть несколько органических «колец» с атомами других элементов, вызывают интерес химиков и фармацевтов благодаря широкому спектру биологической активности. Ранее в РУДН создали гетероциклическое соединение с выраженным противоопухолевым действием. По структуре оно напоминает препараты афтазол и панопрофен, которые обычно используют для борьбы с воспалениями. При этом механизм их действия не до конца известен ученым. Один из показателей эффективности препарата — его связывание с белками крови, поэтому изучение этого процесса важно для понимания работы препарата. Химики РУДН продолжили исследования нового препарата и изучили особенности его биофизического взаимодействия с организмом. Для этого они исследовали, как лекарство связывается с белком циклооксигеназой-1 (PTGS1) и бычьим сывороточным альбумином (BSA).
«Так как молекула созданного лекарственного соединения схожа с коммерческими препаратами пранопрофеном и афтазолом, интересно понять механизм его связывающего взаимодействия с PTGS1 с использованием различных биофизических методов. Понимание взаимодействия с BSA важно, потому что это хорошо известная модельная белковая молекула, которая может принимать различные лекарственные средства и переносить их к заданной молекулярной среде», — кандидат химических наук Алексей Феста, старший преподаватель кафедры органической химии РУДН.
Химики исследовали взаимодействие препарата с BSA и PTGS1 экспериментально и теоретически. Для этого они применили метод флуоресцентной спектроскопии (флуориметрии), а также компьютерное молекулярное моделирование. Флуориметрия позволяет определить концентрацию вещества по интенсивности флуоресценции, которая возникает при его облучении вещества.
Флуоресцентная спектроскопия показала, что при взаимодействии препарата с альбумином возникает эффект так называемого статического тушения. Это означает, что вещества соединились друг с другом, и получился нефлуоресцирующий продукт. Такой эффект (вместе с последующими результатами теоретического моделирования) говорит о том, что соединение идет по принципу гидрофобного взаимодействия. Оно определяет, как в результате будет выглядеть структура соединения. Молекулярное моделирование по методу молекулярного докинга показало, что в соединении с BSA и PTGS1 лекарство устойчиво в течение всего времени симуляции.
«Исследование молекулярного докинга показывает, что препарат обладает хорошей способностью к связыванию как в комплексе с BSA, так и в комплексе с PTGS. При этом теоретически рассчитанная энергия связи почти совпадает с рассчитанной экспериментально. Анализ молекулярной динамики показывает, что препарат стабилен как в комплексной системе с BSA, так и в системе с PTGS1», — Cубрамани Картикеан, постдок кафедры органической химии РУДН.
Результаты опубликованы в Journal of Molecular Structure.
В преддверии 8 Марта мы решили рассказать о некоторых женщинах-ученых РУДН. Сотрудницы вуза поделились с нами, какими достижениями они больше всего гордятся, почему выбрали научную карьеру и о чем мечтают.
В лаборатории факультета искусственного интеллекта (ФИИ) РУДН разработали интеллектуальную систему «Умный отчет». Проект объединяет передовые технологии обработки естественного языка (NLP) и машинного обучения для автоматизации работы с документами и базами данных.
На заседании нового диссертационного совета РУДН по специальностям 2.1.12 «Архитектура зданий и сооружений. Творческие концепции архитектурной деятельности» и 2.1.11 «Теория и история архитектуры, реставрация и реконструкция историко-архитектурного наследия» впервые в истории вуза присуждены ученые степени кандидатов архитектуры трем аспирантам: Наталье Калининой, Евгению Огиенко и Юлии Логиновой.
Их работы, выполненные под руководством опытных научных наставников, получили высокую оценку за новизну, теоретическую и практическую ценность.